非小细胞肺癌的粒子治疗
介绍
胸部恶性肿瘤例如非小细胞肺癌(NSCLC)和食管癌的治疗是复杂且具有挑战的。患者通常在诊断时就处于局部晚期,无法进行手术切除。对于这些患者,放疗联合同步或者序贯化疗,通常是可以选择的治疗方式。遗憾的是,大多数局部晚期肺或食管癌患者都会死于疾病进展;即使经过治疗,中位生存时间也仅为16-28个月,局部复发约占治疗失败的40%-50%。尽管为了提高肿瘤控制和患者生存而采用了放疗剂量提升的策略,但是,近期的III期随机研究评估了胸部放疗剂量提升的价值,结果显示,更高的放疗剂量并没有使局部晚期NSCLC或食管癌患者获益[1,2]。标准剂量和高剂量组的局部控制没有差异,而且提高剂量对患者的生存产生了不利的影响。
标准剂量组和高剂量组的肿瘤相关死亡率相似,说明高剂量组更高的死亡率是来源于非肿瘤相关的原因,确切来说是治疗相关毒性。RTOG 0617的结果显示心脏的受量是生存的独立预后因素,证实了心脏高剂量照射区域较大是高剂量组死亡率更高的原因[1]。目前在多种类型的肿瘤中均报道了放化疗期间治疗导致的淋巴细胞减少和较差的生存之间的关系,包括肺癌、食管癌、头颈部癌、胃肠道癌和宫颈癌[3-6]。
胸部恶性肿瘤治疗中的危及器官包括食管、肺、心脏和骨髓;其它的重要结构或组织包括臂丛神经、皮肤、脊髓和胸壁。原则上,减少毒性最有效的策略是通过先进的技术来减少器官不必要的照射,质子束治疗就是一个例子。由于独特的剂量深度特性,质子治疗可以用来减少靶区近端和远端正常组织的剂量,以便在不增加正常组织受量的同时提高肿瘤剂量,从而提高肿瘤局部控制,减少治疗相关毒性,提高生活质量;因此,与光子治疗相比,质子治疗具有本质上的潜在优势。
然而,粒子治疗(包括质子治疗)比目前能够获得的最好的光子治疗还要昂贵的多,迫切需要能够证实质子治疗临床价值的证据,来证明在医疗服务体系上增加更高的经济负担是正当的。尽管资金花费较高,且缺乏来自直接比较的I类临床证据,世界范围内正在兴建的相关设施的数目证实了日益增加的对于提高肿瘤治疗技术的需求,特别是质子治疗。目前,美国有76家已经运营的粒子治疗中心,其中25家是质子中心,更多的项目正在计划中(粒子治疗协作组,https://www.ptcog.ch/index.php/)。到2015年为止,世界范围内超过154000例患者接受了带电粒子治疗(https://www.ptcog.ch/index.php/)。随着设备的数目和质子治疗应用次数的增加,对于质子治疗物理不确定性的认知以及消除这些不确定性的方法也逐渐增多,从而保证了粒子治疗的精确计划和精确实施。
在这篇综述中,我们总结了使用带电粒子治疗胸部肿瘤的合理性和挑战;我们回顾了到目前为止质子治疗在局部晚期肺癌和食管癌中的临床应用;并对质子治疗未来的发展方向进行了讨论。
带电粒子治疗的剂量学和放射生物学
带电粒子治疗的放射生物学和剂量学特征在其它文章中已有深入的描述[7]。简单来说,带电粒子放疗包括使用带电粒子如质子或碳离子来治疗肿瘤。已有文章较好的分析和描述了带电粒子的深部剂量特征[8]。当一个“快速”的带电粒子迅速穿过物质,它会和原子内的电子发生反应,产生电离,从而沿着它的线路沉积能量和剂量。每单位路线长度能量的丢失是相对固定的,直到它到达一个峰值(即所谓的布拉格峰),在该深度发生能量的沉积,也是能量的功能和带电粒子的特性。越过布拉格峰以后,剩余剂量极少。在被动散射质子治疗(PSPT)中,布拉格峰在纵向和横向上都有分布,形成了一个展开的布拉格峰(SOBP),为整个靶区提供了不均衡的剂量。通过调节器、补偿器和射线束光栅来实现肿瘤的适形分布。
另一方面,笔形束扫描质子治疗使用磁性扫描的较细的质子束,从不同的方向来给予射线,从而产生理想的剂量分布特征。肿瘤被逐层扫描,每一层都给予能量,直到覆盖整个靶区。这项技术为获得理想的剂量分布提供了良好的灵活性和稳定性,使目前最先进的质子治疗技术——调强质子治疗(IMPT)的实施成为可能。很多比较治疗计划的研究已经证实了IMPT比调强光子放疗(IMRT)更具剂量学优势[9,10]。
电离辐射和物质(即组织)之间的生物作用和单位长度传递给物质的能量多少有关【也称为传能线密度(LET)】。对于粒子,比如质子和氦核,LET几乎和光子相等,因此,相对生物学效应也几乎等同于光子(质子和光子的RBE比值约为1.1)[11,12]。对于重离子比如碳离子,在他们射程的最后,电离的密度迅速增大,引起细胞内更大的DNA损伤,从而使碳离子具有更高的RBE(1.5-3)。然而,越来越多的证据显示RBE是一个基于单次放疗剂量、总剂量、LET、细胞和组织类型、终点的选择和其它因素的复杂变量[13,14]。因此,在起始处RBE也许小于1.1,随着深度的增加可能增大,并且可能在射程的末端达到最大。
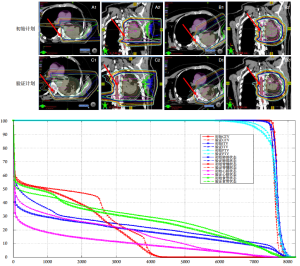
质子的这两大物理特性(即在组织中的射程有限和在射程的末端有更高的RBE)让质子治疗变得既有吸引力,又存在潜在不确定性。质子治疗对肿瘤位置和密度的变化以及组织组成的不同非常敏感,对于胸部肿瘤来说,这种敏感性就变成了不确定性,因为肿瘤随着肺呼吸和膈肌的运动而移动,而且在射线路程上组织的结构及密度都具有明显的异质性。对于PSPT,必须慎重考虑是否需要对肿瘤运动、呼吸导致的肺密度的变化以及呼吸导致的肿瘤运动和肺密度变化而引起的质子射程的不确定进行补偿(图1)。对于每一束射线都应当独立检测这些变量[15]。尽管制定治疗计划时可以通过扩大内边界来消除肺运动和密度的不确定性,但是在实际治疗过程中也必须考虑患者体位和摆位误差以及不同治疗阶段肿瘤体积的变化[16]。
在IMPT中,通过限制靶区内点的位置来实现照射野近端和远端的适形性。动态光栅可以一层一层地改变形状,以解决笔形束扫描质子治疗中出现大斑点的问题。在治疗计划中,靶区内每一条射线的矩阵点的位置和强度都由治疗计划系统自动计算,以获得理想的剂量分布。在开始和运动阶段,IMPT的剂量分布对不确定性的敏感度比PSPT更高。为了解决这种高灵敏度的问题,正在积极研究“健全优化“技术,该技术同时考虑到多种不确定的情况,并且针对所有情况进行优化强度。
NSCLC患者质子治疗的临床预后
尽管肺癌的质子治疗存在技术挑战,治疗组织的异质性导致剂量上显著的不确定性,但是世界范围内新的质子中心的数量呈井喷式增长,截止2015年共有超过154000例多种肿瘤类型的患者接受了质子治疗。然而,发表的结果多数来源于回顾性的、单中心的国家的数据库,或者是单臂的前瞻性研究。获得质子治疗临床证据的前瞻性随机试验目前也已出现。
早期非小细胞肺癌
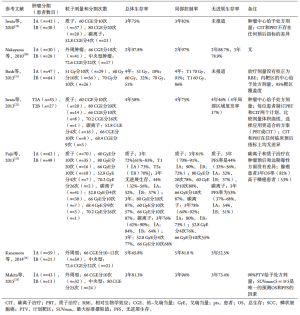
表1总结了自2010年以来发表的关于早期NSCLC质子治疗的代表性研究[19-25]。一项前瞻性II期剂量爬坡试验21报道了剂量是提高总生存的独立因素。在这项研究中,111例早期NSCLC患者(47例T1,64例T2,40%是中央型,60%是周围型)肿瘤靶区剂量给予51Gy,随后序贯加量至60Gy,放疗分割次数为10次。中期分析显示60Gy剂量存在不足,因此在试验的最后阶段将治疗计划修改为剂量提升至70Gy/10f。临床上没有观察到明显的放射性肺炎。全组患者均随访3年以上(中位,48个月),并且观察到生存的提高具有剂量依赖性,51Gy剂量组4年的OS是18%,60Gy组是32%,70Gy组是51%。对于周围型T1的肿瘤,4年的局部控制率是96%,疾病特异性生存率是88%,总体生存率为60%,这些结果与接受光子立体定向消融放疗(SABR)的患者相似[26]。对于T2期的肿瘤,70Gy的剂量水平显示出提高局部控制和生存的趋势。肿瘤大小是唯一的能够预测较高的局部复发和较差的生存的因素,而中心型或外周型并未与任何预后指标存在相关性。那些作者将70Gy作为T1期肿瘤的标准治疗剂量[21]。然而,放疗剂量换算成的RBE是否正确以及计划靶区的剂量覆盖如何也并不明确,因为放疗剂量是施加到肿瘤中心的。
Full table
另外一项由Makita及其同事报道的前瞻性临床试验纳入了56例临床诊断的I期NSCLC(43例T1期,13例T2期)。在2009年1月至2012年5月期间,给予周围型肿瘤的患者66Gy/10f(RBE)的剂量,而对于中央型肿瘤的患者,给予80Gy/25f(RBE)的剂量。处方剂量覆盖90%的计划靶区,后者由肿瘤区外扩10mm形成。3年的总生存率为81.3%,无进展生存率为73.4%,局部控制率为96%。两种剂量方案在预后方面没有显著差异。9例(13.4%)患者出现晚期2度肺毒性,1例(1.5%)患者出现晚期3度肺毒性;无4或5级毒性发生。仅PET上的最大标准摄取值(SUVmax)(<5 vs.≥5)能够预测总体生存和无进展生存[25]。最近一项I期临床研究完成了入组,纳入了25例行质子治疗的I期NSCLC,放疗剂量为60Gy/8f,目前结果正在分析处理中[27]。
对于早期NSCLC的碳离子和质子治疗,Iwata等报道了来自一系列单中心研究的结果,这些研究纳入了80例接受质子治疗(n=57)或碳离子治疗(n=23)的I期NSCLC患者。在质子治疗1组,给予80Gy(RBE)分20次的方案,在质子治疗2组,给予60Gy(RBE)分4次的方案。对于碳离子治疗组,则给予52.8Gy(RBE)分4次的方案。在第一组取得较为满意的初步结果后,研究者在第二组应用质子治疗来缩短总体治疗时间。碳离子治疗的应用始于2005年,此后,为每一位病人都制作了质子和碳离子两套治疗计划,选择其中较优的计划来执行。碳离子治疗组存活病人的中位随访时间是35.5个月。对于全组的80例患者,3年的总体生存率为75%(74%IA,76%IB);疾病相关生存为86%(84%IA,88%IB);局部控制率为82%(87% IA,77%IB)。三个组以及碳离子治疗和质子治疗在治疗结果方面没有显著差异。相同的研究者也分析了前瞻性试验组中,2003年4月至2009年12月接受质子治疗(n=43)或碳离子治疗(n=27)的70例早期NSCLC患者(47 T2a, 23 T2b)肿瘤大小与预后的关系。给予肿瘤中心的总剂量是60Gy(RBE)/10f(20例患者)、52.8Gy(RBE)/4f(16例患者)、66Gy(RBE)/10f(16例患者)、80Gy(RBE)/20f(14例患者)或者其它剂量(4例患者)。截止分析时,存活患者的中位随访时间是51个月。对于全组70例患者,4年的总生存是58%(53% T2a,67% T2b);局部控制率是75%(70% T2a,84% T2b),无进展生存率是46%(43% T2a,52% T2b)。4年的区域复发率是17%。只有2例患者出现3级肺毒性。值得注意的是,每一位患者有碳离子和质子两套治疗计划,选择其中更好的一套计划来执行。未发现碳离子治疗和质子治疗在任何临床预后指标方面存在差异。推荐辅助化疗作为一种合理的选择,在可能的时候能够进一步提高治疗的预后[22]。另外一项比较碳离子和质子治疗的回顾性研究的结果与Iwata等研究的结果一致,也未发现两种治疗方法在任何临床预后指标方面存在差异。23近期一项meta分析比较了SABR和大分割质子治疗的总体生存,多因素分析显示没有统计学差异,即使单因素分析显示大分割质子放疗能够提高总体生存[28]。
图像引导的SABR【也成为体部立体定向放疗(SBRT)】已经成为无法耐受手术或不可手术患者的治疗选择,也是可以手术但选择非手术治疗患者的最佳替代选择[29,30]。对于周围型IA期NSCLC患者,图像引导的SABR能够获得极好的局部控制率(从80%到97.6%),生存率大约为55%,而且毒性极少[30,31]。105Gy或者更高的生物等效剂量(BED)和更好的生存相关(BED≥105Gy中位生存时间28个月,BED<105Gy中位生存时间22个月)[32]。大肿瘤的患者中,150Gy的BED尤其和更好的肿瘤控制和生存相关[33]。
尽管周围型肺癌可以接受高BED治疗,但是对于中央型肿瘤,由于重要结构如支气管、大血管、心脏、脊髓、食管和气管的存在,高BED治疗会导致远期的毒性[26]。随着图像引导的加入和技术方面的其它进步,质子治疗允许剂量提升或者治疗加速,可以获得更好的生存,并减少毒性,尤其对于中央型或者大肿块的不太适合SABR治疗的早期NSCLC患者。
局部晚期NSCLC
与早期患者相比,局部晚期NSCLC肿瘤特异性死亡率非常高,治疗极具挑战性。放射治疗是其主要的治疗方式,目前的标准治疗是放疗联合化疗。尽管局部晚期NSCLC患者转移风险较高,但是很多患者死于胸内肿瘤未控,因此,提高局控对于患者的生存大有益处。
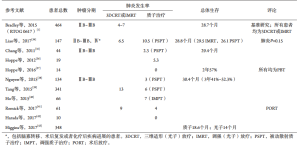
质子治疗在毒性和生存方面可能的获益已被评估过(表2)[1,34-43]。几项回顾性研究显示,与光子治疗相比,质子治疗能够降低同步放化疗带来的肺、食管和血液学毒性,肿瘤的局部控制和生存均在可接受范围内。44一项前瞻性纵向观察研究纳入了82例不可切除的原发或复发的NSCLC患者,这些患者接受三维适形放疗(3DCRT)、IMRT或质子治疗,该研究包括了病人报告的症状负荷,根据MD Anderson的症状目录,每周进行监测,共进行12周。不考虑治疗方法,疲乏是最严重的症状。尽管质子治疗组比IMRT及3DCRT治疗组接受了更高的靶区剂量(P<0.001),接受质子治疗后发生严重症状的患者要显著少于接受IMRT或3DCRT的患者[45]。
Full table
近期一项非随机个体观察研究报道了局部晚期NSCLC患者前瞻性接受质子治疗(60-74Gy RBE)同步化疗的疗效,总体生存时间极好,II期患者中位生存时间40.4个月,III期患者30.4个月,毒性可以耐受[38]。这与Chang等在74Gy质子治疗同步化疗的前瞻性单臂II期研究中报道的中位生存时间29.4个月相一致[35]。国家癌症数据库分析了接受光子或质子治疗的NSCLC患者,共挑选出超过 243800例患者,只有348例接受了光子治疗。尽管两个治疗组的患者数目不均衡,倾向评分匹配后显示质子治疗和更好的生存相关[34]。
廖和其团队报道了首个直接比较PSPT和IMRT同步化疗治疗不可手术NSCLC疗效的随机性试验(NCT00915005)。研究假设是,与IMRT相比,PSPT能够减少肺组织受量,从而在不降低肿瘤控制的情况下减轻毒性。纳入的患者为IIIB-IV期且适合行同步放化疗的NSCLC患者(单个脑转移的IV期患者、术后肺或纵隔复发的患者也纳入此研究)。每一位患者均成对制作两个计划(IMRT和PSPT)。只有当两个治疗计划在同一肿瘤剂量下的危及器官受量均令人满意,才将患者纳入随机。这项试验的结果显示PSPT没有改善肺或食管的受量,但是心脏的受量有所改善。与IMRT相比,PSPT在肺炎或局部失败率方面并没有使患者获益。PSPT治疗的患者(57例)肺受量比IMRT(92例患者)少5-10Gy(RBE);肺≥20Gy的受照体积更多;心脏所有剂量水平的照射面积更少(5-80Gy(RBE))。全组患者放射性肺炎的发生率是8.1%(6.5% IMRT,10.5% PSPT),局部失败率是10.7%(10.9%和10.5%)[34]。
探索性的研究显示,PSPT治疗后正常肺在PET上的FDG摄取比IMRT治疗后更高[46]。平均肺剂量是IMRT治疗后唯一能够预测肺毒性的因素,而接受高剂量照射的肺体积是PSPT治疗后唯一能够预测肺毒性的因素[47]。导致这些结果的原因可能在于PSPT三维适形的本质、与它相关的计划和实施流程、IMRT对正常关键器官的保护、以及为了消除质子治疗对分次照射之间和单次照射内不确定的高度敏感性而对照射体积进行的扩大。理论上,通过改进质子治疗的实施和IMPT技术的应用,可以解决质子利用较大的靶区外扩范围来抵消PSPT临床实施的不确定性的问题。
RTOG 0617发现心脏V5和V35是总体生存的预测因素。徐和其团队使用了一种超灵敏的技术来测量心肌肌钙蛋白,一种放化疗后心肌损伤的生物标志物。他们发现胸部放疗期间,当心脏平均剂量达到20Gy或更高的水平,心肌肌钙蛋白的水平升高,但是当心脏平均剂量为2Gy或更少,肌钙蛋白的水平则不会变化。肌钙蛋白水平相对于治疗前基线增加2倍以上是总体生存方面显著的不良预后因素[48]。到目前为止,所有比较质子和光子治疗方案的剂量学研究都显示,在所有剂量水平上,心脏的受照体积都显著减少。随机性试验NCT00915005的二次分析PSPT明显降低了心脏剂量[49]。减少心脏不必要的照射最终可能转化为生存的获益。RTOG 1308,一项比较质子和光子治疗的III期随机试验,以生存为主要研究终点,其结果有助于回答该问题[50]。
淋巴细胞,特别是CD8 T细胞,是放射治疗引起的抗肿瘤免疫反应的重要组成部分[51,52]。Tang等人报道,首次放疗后NSCLC患者的淋巴细胞数量就开始下降,一直持续到治疗结束,之后就开始恢复。淋巴细胞最低值和肿瘤体积以及低剂量区(使用肺V5作为替代)相关。最有趣的是,淋巴细胞最低值和无进展生存以及总体生存都密切相关[53]。这项发现在其它类型肿瘤中也得到了证实,包括食管癌、肝癌和小细胞肺癌,提示淋巴细胞减少可能是影响多个病种总体生存的普遍因素[54-58]。质子治疗能够显著减少任何位置肿瘤的低剂量区,因此也能有助于避免淋巴细胞减少。目前正在积极进行相关研究,探索质子治疗在该领域的潜在作用。
尽管NSCLC的标准治疗方案是放疗同步化疗,后者的加入能够提高放疗敏感性,但是高达40%的患者会出现局部区域复发,而其中1/4会发生孤立性的局部区域复发[59]。对于既往接受过放疗的复发患者,其治疗尤其具有挑战。从历史上来看,这些患者通常接受全身治疗,要么接受细胞毒性化疗,要么越来越多地接受免疫治疗,因为他们担心再次放疗可能会出现严重的、潜在的致命并发症。
然而,不幸的是,单纯的化疗并不是一种根治性的方法,而且当它用于复发性疾病时,通常反应率有限[60]。
粒子治疗非常适合应对再放疗带来的挑战[61]。随着射线越过布拉格峰后剂量快速跌落,粒子治疗可以最有效地躲避关键的危及器官,这些器官可能已从之前的治疗中接受了高剂量的照射,从而提供了一个比光子治疗毒性风险更小的潜在根治性治疗的选择[62]。MD安德森癌症中心的研究人员发表了一份关于粒子再放疗的早期报告。33例胸腔内复发的NSCLC患者中,质子再放疗(中位剂量66Gy,初始疗程63Gy后中位间隔36个月)1年总生存率为47%,1年局部区域控制率54%。严重(3级)食管毒性的发生率是9%,严重的肺毒性为21%[63]。近期,同一机构的研究人员报道了27例(其中22例是NSCLC)接受IMPT再放疗患者的治疗结果(中位剂量为66Gy EQD2 Gy);中位随访时间11.2个月,中位总体生存时间18个月,1年局部失败率为78%,晚期3级肺毒性7%,无3级食管炎发生[64]。
最后,近期一项多中心前瞻性研究报道了57例因局部复发行再放疗的NSCLC患者的治疗结果(中位剂量66.6Gy)。其中三分之二的患者接受了同步化疗。中位随访时间7.8个月,局部区域复发率25%,包括16%的局部复发。1年总生存率为59%,1年无进展生存率为58%,总生存率随着食管平均剂量的增加而下降。24例患者(42%)出现3级急性或晚期毒性;当肿瘤体积与中央气道的区域重叠时,毒性更为常见,食管和心脏的平均剂量和同步化疗的使用与更高的毒性发生率相关[65]。
总结和未来的方向
粒子治疗因其优异的剂量分布,使得在治疗胸部肿瘤方面具有巨大的潜力。然而,将质子治疗的剂量学优势转化为胸部肿瘤患者的临床获益仍具有挑战,这项挑战才刚开始引起重视,而质子治疗技术的发展至少落后光子治疗技术20年。首先,质子在束流路径中更容易受到其固有的异质性、肿瘤和器官运动、治疗过程中解剖位置的变化等因素的影响,这对质子治疗的精确计划、精确放疗实施提出了巨大挑战。为了充分发挥粒子治疗胸部肿瘤的潜力,需要对治疗过程的各个方面进行广泛的改进,从模拟、计划算法、容积图像引导到实时根据和治疗适应,以充分发挥粒子治疗胸部肿瘤的潜力。高度适形的剂量分布是证明质子治疗在预防放射性肺炎方面临床优势的基础和必要条件,因为扩大靶区边界以抵消不确定性的做法将会消除质子的剂量学优势。其次,目前常用的基于光子治疗的正常组织并发症概率模型并不适用于质子治疗,需要结合质子剂量分布的特征和RBE变化来建议质子治疗特异性的预测模型。第三,继续设计和开展“智能”质子治疗试验,建立临床证据和选择患者的标准,是质子治疗成为真正个体化的治疗。未来的比较试验可以集中于所有部位肿瘤的共同研究终点,如心脏毒性、低剂量区和淋巴细胞减少症,而不是在某一特定类型肿瘤中将一种治疗模式和另外一种进行比较。最后,要想提高质子治疗的剂量学和生物学优势以改善临床疗效,需要进行积极的和创造性的研究,特别是图像引导的大分割IMPT和大分割质子放疗与免疫治疗的结合。
Acknowledgements
The authors thank Christine Wogan of MD Anderson’s Division of Radiation Oncology for editorial contributions.
Funding: Supported in part by U19CA021239 and by NIH Core grant to University of Texas MD Anderson Cancer Center.
Footnote
Conflicts of Interest: The authors have no conflicts of interest to declare.
References
- Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol 2015;16:187-99. [Crossref] [PubMed]
- Minsky BD, Pajak TF, Ginsberg RJ, et al. INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy. J Clin Oncol 2002;20:1167-74. [Crossref] [PubMed]
- Wu ES, Oduyebo T, Cobb LP, et al. Lymphopenia and its association with survival in patients with locally advanced cervical cancer. Gynecol Oncol 2016;140:76-82. [Crossref] [PubMed]
- Campian JL, Sarai G, Ye X, et al. Association between severe treatment-related lymphopenia and progression-free survival in patients with newly diagnosed squamous cell head and neck cancer. Head Neck 2014;36:1747-53. [Crossref] [PubMed]
- Kou F, Lu Z, Li J, et al. Pretreatment lymphopenia is an easily detectable predictive and prognostic marker in patients with metastatic esophagus squamous cell carcinoma receiving first-line chemotherapy. Cancer Med 2016;5:778-86. [Crossref] [PubMed]
- Wild AT, Ye X, Ellsworth SG, et al. The Association Between Chemoradiation-related Lymphopenia and Clinical Outcomes in Patients With Locally Advanced Pancreatic Adenocarcinoma. Am J Clin Oncol 2015;38:259-65. [Crossref] [PubMed]
- Mohan R, Grosshans D. Proton therapy - Present and future. Adv Drug Deliv Rev 2017;109:26-44. [Crossref] [PubMed]
- Durante M, Paganetti H. Nuclear physics in particle therapy: a review. Rep Prog Phys 2016;79:096702. [Crossref] [PubMed]
- Zhang X, Li Y, Pan X, et al. Intensity-modulated proton therapy reduces the dose to normal tissue compared with intensity-modulated radiation therapy or passive scattering proton therapy and enables individualized radical radiotherapy for extensive stage IIIB non-small-cell lung cancer: a virtual clinical study. Int J Radiat Oncol Biol Phys 2010;77:357-66. [Crossref] [PubMed]
- Ishikawa H, Hashimoto T, Moriwaki T, et al. Proton beam therapy combined with concurrent chemotherapy for esophageal cancer. Anticancer Res 2015;35:1757-62. [PubMed]
- Paganetti H. Relative biological effectiveness (RBE) values for proton beam therapy. Variations as a function of biological endpoint, dose, and linear energy transfer. Phys Med Biol 2014;59:R419-72. [Crossref] [PubMed]
- Gerweck LE, Kozin SV. Relative biological effectiveness of proton beams in clinical therapy. Radiother Oncol 1999;50:135-42. [Crossref] [PubMed]
- Britten RA, Nazaryan V, Davis LK, et al. Variations in the RBE for cell killing along the depth-dose profile of a modulated proton therapy beam. Radiat Res 2013;179:21-8. [Crossref] [PubMed]
- Guan F, Bronk L, Titt U, et al. Spatial mapping of the biologic effectiveness of scanned particle beams: towards biologically optimized particle therapy. Sci Rep 2015;5:9850. [Crossref] [PubMed]
- Moyers MF. Proton therapy. In: VanDyk J. editor. The Modern Technology of Radiation Oncology. A Compendium for Medical Physicists and Radiation Oncologists. Madison, WI: Medical Physics, 1991.
- Hui Z, Zhang X, Starkschall G, et al. Effects of interfractional motion and anatomic changes on proton therapy dose distribution in lung cancer. Int J Radiat Oncol Biol Phys 2008;72:1385-95. [Crossref] [PubMed]
- Liu W, Zhang X, Li Y, et al. Robust optimization of intensity modulated proton therapy. Med Phys 2012;39:1079-91. [Crossref] [PubMed]
- Liu W, Liao Z, Schild SE, et al. Impact of respiratory motion on worst-case scenario optimized intensity modulated proton therapy for lung cancers. Pract Radiat Oncol 2015;5:e77-86. [Crossref] [PubMed]
- Iwata H, Murakami M, Demizu Y, et al. High-dose proton therapy and carbon-ion therapy for stage I nonsmall cell lung cancer. Cancer 2010;116:2476-85. [PubMed]
- Nakayama H, Sugahara S, Tokita M, et al. Proton beam therapy for patients with medically inoperable stage I non-small-cell lung cancer at the University of Tsukuba. Int J Radiat Oncol Biol Phys 2010;78:467-71. [Crossref] [PubMed]
- Bush DA, Cheek G, Zaheer S, et al. High-dose hypofractionated proton beam radiation therapy is safe and effective for central and peripheral early-stage non-small cell lung cancer: results of a 12-year experience at Loma Linda University Medical Center. Int J Radiat Oncol Biol Phys 2013;86:964-8. [Crossref] [PubMed]
- Iwata H, Demizu Y, Fujii O, et al. Long-term outcome of proton therapy and carbon-ion therapy for large (T2a-T2bN0M0) non-small-cell lung cancer. J Thorac Oncol 2013;8:726-35. [Crossref] [PubMed]
- Fujii O, Demizu Y, Hashimoto N, et al. A retrospective comparison of proton therapy and carbon ion therapy for stage I non-small cell lung cancer. Radiother Oncol 2013;109:32-7. [Crossref] [PubMed]
- Kanemoto A, Okumura T, Ishikawa H, et al. Outcomes and prognostic factors for recurrence after high-dose proton beam therapy for centrally and peripherally located stage I non--small-cell lung cancer. Clin Lung Cancer 2014;15:e7-12. [Crossref] [PubMed]
- Makita C, Nakamura T, Takada A, et al. High-dose proton beam therapy for stage I non-small cell lung cancer: Clinical outcomes and prognostic factors. Acta Oncologica 2015;54:307-14. [Crossref] [PubMed]
- Timmerman R, McGarry R, Yiannoutsos C, et al. Excessive toxicity when treating central tumors in a phase II study of stereotactic body radiation therapy for medically inoperable early-stage lung cancer. J Clin Oncol 2006;24:4833-9. [Crossref] [PubMed]
- Wink KC, Roelof E, Simone CB 2nd, et al. Photons, protons or carbon ions for stage I non-small cell lung cancer - Results of the multicentric ROCOCO in silico study. Radiother Oncol 2018. [Epub ahead of print]. [Crossref] [PubMed]
- Chi A, Chen H, Wen S, et al. Comparison of particle beam therapy and stereotactic body radiotherapy for early stage non-small cell lung cancer: A systematic review and hypothesis-generating meta-analysis. Radiother Oncol 2017;123:346-54. [Crossref] [PubMed]
- Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol 2015;16:630-7. [Crossref] [PubMed]
- Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010;303:1070-6. [Crossref] [PubMed]
- Onishi H, Araki T, Shirato H, et al. Stereotactic hypofractionated high-dose irradiation for stage I nonsmall cell lung carcinoma: clinical outcomes in 245 subjects in a Japanese multiinstitutional study. Cancer 2004;101:1623-31. [Crossref] [PubMed]
- Stahl JM, Ross R, Harder EM, et al. The effect of biologically effective dose and radiation treatment schedule on overall survival in stage I non-small cell lung cancer patients treated With stereotactic body radiation therapy. Int J Radiat Oncol Biol Phys 2016;96:1011-20. [Crossref] [PubMed]
- Koshy M, Malik R, Weichselbaum RR, et al. Increasing radiation therapy dose is associated with improved survival in patients undergoing stereotactic body radiation therapy for stage I non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2015;91:344-50. [Crossref] [PubMed]
- Liao Z, Lee JJ, Komaki R, et al. Bayesian adaptive randomization trial of passive scattering proton therapy and intensity-modulated photon radiotherapy for locally advanced non–small-cell lung cancer. J Clin Oncol 2018.JCO2017740720. [PubMed]
- Chang JY, Komaki R, Lu C, et al. Phase 2 study of high-dose proton therapy with concurrent chemotherapy for unresectable stage III nonsmall cell lung cancer. Cancer 2011;117:4707-13. [Crossref] [PubMed]
- Hoppe BS, Flampouri S, Henderson RH, et al. Proton therapy with concurrent chemotherapy for non-small-cell lung cancer: technique and early results. Clin Lung Cancer 2012;13:352-8. [Crossref] [PubMed]
- Hoppe BS, Henderson R, Pham D, et al. A phase 2 trial of concurrent chemotherapy and proton therapy for stage III non-small cell lung cancer: results and reflections following early closure of a single-institution study. Int J Radiat Oncol Biol Phys 2016;95:517-22. [Crossref] [PubMed]
- Nguyen QN, Ly NB, Komaki R, et al. Long-term outcomes after proton therapy, with concurrent chemotherapy, for stage II-III inoperable non-small cell lung cancer. Radiother Oncol 2015;115:367-72. [Crossref] [PubMed]
- Tang C, Gomez DR, Wang H, et al. Association between white blood cell count following radiation therapy with radiation pneumonitis in non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2014;88:319-25. [Crossref] [PubMed]
- Ho JC, Li H, Allen P, et al. Clinical Outcome of Intensity Modulated Proton Therapy for Non-Small Cell Lung Cancer. International Journal of Radiation Oncology Biology Physics 2015;93:188. [Crossref]
- Remick JS, Schonewolf C, Gabriel P, et al. First clinical report of proton beam therapy for postoperative radiotherapy for non-small-cell lung cancer. Clin Lung Cancer 2017;18:364-71. [Crossref] [PubMed]
- Harada H, Fuji H, Ono A, et al. Dose escalation study of proton beam therapy with concurrent chemotherapy for stage III non-small cell lung cancer. Cancer Sci 2016;107:1018-21. [Crossref] [PubMed]
- Higgins KA, O'Connell K, Liu Y, et al. National Cancer Database analysis of proton versus photon radiation therapy in non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2017;97:128-37. [Crossref] [PubMed]
- Sejpal S, Komaki R, Tsao A, et al. Early findings on toxicity of proton beam therapy with concurrent chemotherapy for nonsmall cell lung cancer. Cancer 2011;117:3004-13. [Crossref] [PubMed]
- Wang XS, Shi Q, Williams LA, et al. Prospective study of patient-reported symptom burden in patients with non-small-cell lung cancer undergoing proton or photon chemoradiation therapy. J Pain Symptom Manage 2016;51:832-8. [Crossref] [PubMed]
- Yue J, McKeever M, Sio T, et al. Association of lung fluorodeoxyglucose uptake with radiation pneumonitis after concurrent chemoradiation for non-small cell lung cancer. Clin Transl Radiat Oncol 2017;4:1-7. [Crossref] [PubMed]
- Shusharina N, Liao Z, Mohan R, et al. Differences in lung injury after IMRT or proton therapy assessed by 18FDG PET imaging. Radiother Oncol 2018. [Epub ahead of print]. [PubMed]
- Xu T, Meng QH, Gomez DR, et al. Serum troponin T levels are associated with radiation dose to heart during definitive chemoradiation therapy for non-small cell lung cancer Int J Radiat Oncol Biol Phys 2015;93:E411-2. (abstract). [Crossref]
- Deist T, Yang P, Oberije C, et al. Dosimetric analysis of randomized lung proton and photon plans with respect to radiation toxicity (OC-1144). Radiother Oncol 2017;123:S70-1. [Crossref]
- Giaddui T, Chen W, Yu J, et al. Establishing the feasibility of the dosimetric compliance criteria of RTOG 1308: phase III randomized trial comparing overall survival after photon versus proton radiochemotherapy for inoperable stage II-IIIB NSCLC. Radiat Oncol 2016;11:66. [Crossref] [PubMed]
- Formenti SC, Demaria S. Combining radiotherapy and cancer immunotherapy: a paradigm shift. J Natl Cancer Inst 2013;105:256-65. [Crossref] [PubMed]
- Twyman-Saint Victor C, Rech AJ, Maity A, et al. Radiation and dual checkpoint blockade activate non-redundant immune mechanisms in cancer. Nature 2015;520:373-7. [Crossref] [PubMed]
- Tang C, Liao Z, Gomez D, et al. Lymphopenia association with gross tumor volume and lung V5 and its effects on non-small cell lung cancer patient outcomes. Int J Radiat Oncol Biol Phys 2014;89:1084-91. [Crossref] [PubMed]
- Feng JF, Liu JS, Huang Y. Lymphopenia predicts poor prognosis in patients with esophageal squamous cell carcinoma. Medicine (Baltimore) 2014;93:e257. [Crossref] [PubMed]
- Grossman SA, Ellsworth S, Campian J, et al. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw 2015;13:1225-31. [Crossref] [PubMed]
- Mendez JS, Govindan A, Leong J, et al. Association between treatment-related lymphopenia and overall survival in elderly patients with newly diagnosed glioblastoma. J Neurooncol 2016;127:329-35. [Crossref] [PubMed]
- Cho O, Oh YT, Chun M, et al. Radiation-related lymphopenia as a new prognostic factor in limited-stage small cell lung cancer. Tumour Biol 2016;37:971-8. [Crossref] [PubMed]
- Kuo P, Bratman SV, Shultz DB, et al. Galectin-1 mediates radiation-related lymphopenia and attenuates NSCLC radiation response. Clin Cancer Res 2014;20:5558-69. [Crossref] [PubMed]
- Curran WJ, Paulus R, Langer CJ, et al. Sequential vs. concurrent chemoradiation for stage III non-small cell lung cancer: randomized phase III trial RTOG 9410. J Natl Cancer Inst 2011;103:1452-60. [Crossref] [PubMed]
- Noble J, Ellis PM, Mackay JA, et al. Second-line or subsequent systemic therapy for recurrent or progressive non-small cell lung cancer: a systematic review and practice guideline. J Thorac Oncol 2006;1:1042-58. [Crossref] [PubMed]
- Simone CB 2nd, Rengan R. The use of proton therapy in the treatment of lung cancers. Cancer J 2014;20:427-32. [Crossref] [PubMed]
- Lin SH, Merrell KW, Shen J, et al. Multi-institutional analysis of radiation modality use and postoperative outcomes of neoadjuvant chemoradiation for esophageal cancer. Radiother Oncol 2017;123:376-81. [Crossref] [PubMed]
- McAvoy SA, Ciura KT, Rineer JM, et al. Feasibility of proton beam therapy for reirradiation of locoregionally recurrent non-small cell lung cancer. Radiother Oncol 2013;109:38-44. [Crossref] [PubMed]
- Ho JC, Nguyen QN, Li H, et al. Reirradiation of thoracic cancers with intensity modulated proton therapy. Pract Radiat Oncol 2018;8:58-65. [PubMed]
- Chao HH, Berman AT, Simone CB 2nd, et al. Multi-institutional prospective study of reirradiation with proton beam radiotherapy for locoregionally recurrent non-small cell lung cancer. J Thorac Oncol 2017;12:281-92. [Crossref] [PubMed]
徐利明
天津医科大学肿瘤医院(更新时间:2021.7)
蔡文杰
福建医科大学附属泉州第一医院(更新时间:2021.7)
王家强
福建医科大学附属泉州第一医院(更新时间:2021.7)
(本译文仅供学术交流,实际内容请以英文原文为准。)