早期非小细胞肺癌的质子放疗
背景
在多种恶性肿瘤和临床疾病中,质子放疗(proton beam therapy,PBT)的价值均在不断探索。对于早期非小细胞肺癌(non-small cell lung cancer,NSCLC),PBT作为最佳的治疗选择正在接受着不断的挑战。这是因为,越来越多的证据显示,立体定向消融放疗(stereotactic ablative body radiation,SABR)局部控制率高,耐受性好[1,2]。据此,立体定向质子放疗(stereotactic body proton therapy,SBPT)的适应症最终将会局限在SABR实现困难的病例,比如:中央型肺癌患者或再程放疗患者。本文将重点介绍早期NSCLC应用PBT的数据,为患者选择提供一般性建议;并将介绍SBPT技术的概况。最终,我们将展现PBT用于某些特殊类型的早期NSCLC的理论基础;此部分内容也将在未来5到10年不断完善。
早期NSCLC应用PBT的剂量学原理
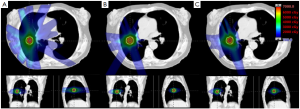
几项研究比较了早期肺癌应用PBT和SABR的剂量学差异。尽管SABR对肺和其他危及器官的照射很少,剂量学研究显示,PBT依然存在剂量学优势。例如,日本研究者评估了21例接受立体定向放射治疗(stereotactic body radiotherapy,SBRT)或PBT的I期NSCLC患者,主要研究目的为比较两种技术的剂量体积直方图(dose-volume histogram,DVH)的参数。应用PBT技术时,肺V5、V10和V20分别为13.2%、11.4%和10.1%;应用SBRT时相应参数分别为32.0%、21.8%和11.4%。作者认为,对于较大或多发的早期肺癌,PBT“可能更优于”SBRT[3]。MD安德森癌症中心的研究者发现,SBRT计划的V5、V10和V20分别为31.8%,24.6%和15.8%;PBT计划的相应参数分别为13.4%、12.3%和10.9%[4]。这些研究为临床医生解答了一个重要问题,如何选择最佳的治疗技术:与SBRT相比,PBT是否在低剂量区(V5,V10)具有足够的优势。需要特别指出的是,大部分关于早期肺癌的放疗剂量学研究均使用的是被动散射PBT。通过局部晚期肺癌的剂量学报道发现,笔形束扫描/调强质子治疗(intensity-modulated proton therapy,IMPT)的应用使得剂量学优势更加明显[5]。在未来开展的早期NSCLC应用PBT的研究中,IMPT的剂量学优势可能会得到验证,其获益将会更加明显(图1)。
早期NSCLC应用PBT的回顾性和单臂前瞻性临床研究
大多数应用PBT治疗早期肺癌的临床经验来自Loma Linda癌症中心,该中心应用PBT治疗早期肺癌的经验超过15年[6,7]。2010年,该中心的一项单臂II期研究,报道了54例患者的合并症调整生存分析。使用Charlson合并症指数(Charlson Comorbidity Index),研究者制作了预测生存曲线,并与肺癌以外原因的死亡率进行了比较。应用该方法,预测的2年和4年的总生存(overall survival,OS)分别为67%和50%;与实际并发症特异生存率一致(分别为64%和45%)[8]。该数据与研究者之前报道的PBT的生存数据一致。
3年后,Loma Linda癌症中心报道了应用大分割PBT治疗早期NSCLC的12年经验;该研究是最大规模的数据报道,并提供了一些治疗细节。研究共报道了111例患者,早期入组的患者接受放疗剂量51-50Gy,随后入组的患者剂量逐渐提升到70Gy,均为10次分割,两周完成。与SBRT用于早期肺癌的研究结果一致,该研究发现,提高放疗剂量可以提高OS。实际上,51Gy、60Gy、70Gy剂量组的4年生存率分别为18%、32%和51%(P=0.006)。外周型T1肿瘤的局部控制率可达96%。对于T2肿瘤,60Gy组局部控制率为45%,70Gy组的局部控制率为74%(P=0.10)。之后,针对四个研究终点(OS、疾病特异生存、局部控制和远处转移)进行了多因素分析。结果,肿瘤位置(中央型vs.外周型)与上述研究终点没有相关性。肿瘤大小是唯一与上述四项研究终点相关的因素。对于副作用,没有患者出现临床上需要激素或住院治疗的放射性肺炎;患者的肺功能也没有显著下降,包括FEV1和肺弥散功能。综合上述结果,作者认为PBT治疗早期肺癌获得了出色结果,包括中央型肺癌和外周型肺癌;对于较大肿瘤,提升剂量将会改善生存结果[9]。
除了上述结果,其他中心也报道了PBT治疗早期肺癌的结果。MD安德森癌症中心报道了18例不适合手术和手术困难的患者接受改良大分割质子放疗的结果,患者包括T1N0的中央型肺癌以及T2-T3N0的肺癌。剂量分割方案为87.5 Gy/35次,2.5 Gy/次。中位随访16.3个月,唯一的3度副作用为皮肤反应(17%),局部控制率为89%,区域淋巴结失败率为11.1%,远处转移率为27.8%,生存情况受到远处转移的影响。作者认为,该治疗方案耐受性好,治疗结果理想[10]。2017年该研究数据进行了更新,患者增加到38例,中位随访83.1个月。5年无局部复发生存率为85.0%,5年无区域复发生存率为89.2%,5年无远处转移生存率为54.4%;上述数据与SABR相仿。未发现更多的3级毒性[11]。该研究的局限性在于使用了35次的分割模式,该分割模式已经不再常规应用于适合SABR的患者。然而,该II期研究中大部分患者被分配到了这种改良大分割方案,因此,有理由推断研究结论可以推广用于其他的消融剂量。
最近,一项系统回顾研究比较了粒子束放疗和SABR。通过搜索2000年至2016年PubMed、Medline、Google Scholar和Cochrane图书馆数据库,研究纳入了72个SBRT研究和9个大分割PBT研究。有趣的是,单因素分析发现PBT可以提高OS(P=0.005)和无进展生存(progression-free survival,PFS)(P=0.01);多因素模型中纳入可手术肿瘤占比后,上述生存获益(与SABR相比)消失。实际上,在所有研究因素中,能否手术是生存最强的影响因素,这也暗示,在评价早期肺癌的预后时,其他与该因素相关的临床因素,比如功能状态,也会影响到结果[12]。同时需要强调的是,该研究中多因素分析未能显示出生存具有统计学上的获益,该研究结果显示PBT和SABR疗效相当。考虑到几乎所有PBT患者均接受的被动散射PBT,并且没有图像引导技术,建议将来开展比较这两种放疗的研究时使用这些新的放疗技术。
早期肺癌质子放疗的患者选择共识
2015年,国际粒子治疗协作组(International Particle Therapy Cooperative Group,PTCOG)发表了早期和局部晚期NSCLC使用PBT的共识[13]。该组织认为,对于小的外周型病变,尤其是无法进行容积成像时,PBT的获益尚不明确。对于较大肿瘤,PBT的剂量优势明显,有理由认为PBT可以替代SABR。该共识推荐将PBT用于胸壁和肋骨受照剂量高的外周型肺癌。共识强烈推荐患者选择与肿瘤位置相关,作者指出PBT在保护重要的中央器官(如大气道、食管、脊髓)时有显著的剂量学获益;上述这些情况考虑使用质子放疗。最后,共识指出,肿瘤靠近臂丛的患者和多发肿瘤的患者,这两种患者也会从PBT中获益。在讨论靠近臂丛肿瘤治疗时,作者参考了一篇PBT改善肺尖肿瘤剂量分布的研究[14],以及一篇SBRT臂丛毒性的研究[15]。而对于多发肿瘤,资料来自一篇关于PBT治疗多发肿瘤的个案报道[16]。
PBT对比SABR用于早期NSCLC的随机对照研究
MD安德森癌症中心进行了一项早期NSCLC应用SABR和SBPT的II期随机研究。因为PBT在小的外周型肺癌中没有明确获益,因此,仅具有“高危”特征的患者入组,包括:(1)中央型肺癌;(2)<5cm的T3病变;(3)孤立的肺内复发病灶。放疗剂量为50Gy/4次,放疗处方给在计划靶区(planning target volume,PTV)上。SBPT使用被动散射计划。研究主要终点为治疗相关毒性,研究假设PBT可以降低高危患者的不良反应发生率。
研究于2012年10月至2014年6月开放入组,因为入组困难而关闭,期间共21例患者纳入研究。研究未发现4级和5级毒性,SBPT组有一例患者出现3度皮肤纤维化。SBRT组和SBPT组的三年局部控制率相仿(87.5% vs. 90%)。需要注意的是,SBRT组的死亡率高于预期,一例患者不明原因死亡,两例患者死因与治疗无关。作者的结论是两种技术的副作用均可接受,目前尚无法证实SBPT差于SBRT[17]。
除了上述副作用和疗效的数据外,该研究展示了开展SBPT对比SABR的随机性研究的困难性。特别是研究开展期间尚没有开始应用容积成像技术,因此几乎所有接受SBPT的患者均接受了定位标记植入,实际上患者常常不情愿接受该操作。保险审批的流程也会延迟治疗,影响到了患者入组和随机;许多患者最终拒绝了质子放疗,或者不愿因为等待财务清算而延迟治疗。此外,和其他纳入PBT的研究一样,患者常常倾向选择治疗方案中的一种,使得随机非常困难。最后,入组标准中仅选择高危的病变,也增加了患者入组的难度。目前,容积成像技术逐渐开展,可以克服第一项障碍以促进患者入组,但是另外两项难点仍很难解决;因此,未来的随机研究可能需要改成多中心研究以加速入组。
SBPT应用指南
一般情况下,患者接受SBPT时采用与SABR相同的模拟定位和靶区勾画方法,同时,也采用相同的图像引导方案。模拟定位时,患者双臂置于头顶,固定并获取四维图像。在MD安德森癌症中心,肿瘤动度超过1cm时使用呼吸控制技术。大体肿瘤体积(gross tumor volume,GTV)依据最大密度投影(maximum intensity projection,MIP)勾画,勾画出包含肿瘤动度的GTV内靶区(internal GTV,iGTV)。依据肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)指南,iGTV外放5mm边界获得PTV。
质子治疗计划中,GTV或临床靶体积(clinical target volume,CTV)作为靶器官进行计划设计,PTV用于治疗计划的评估。至少95%的PTV需要接受100%的处方剂量,而100%的PTV必须接受95%的处方剂量[14]。每个计划使用4个或4个以上的共面野,以减少胸壁剂量和肺脏的出射剂量。对于被动散射质子放疗(passive scattering proton therapy,PSPT)计划, 每个照射野均依据CTV的近端和远端边界设计了挡块和质子束,并使用适当模糊边界的补偿器来适形Bragg峰扩展边界的远端;该方法在之前的研究中有具体描述[18]。IMPT计划使用鲁棒优化(robust optimization)并考虑摆位误差和范围不确定性[19]。依据剂量、结构是否超过最大耐受剂量(maximum tolerated dose,MTD)来确定重要结构的权重。在吸气末和呼气末CT进行计算来完成鲁棒评价(robust evaluation)和剂量分布确认,以保证在呼吸活动、摆位误差和范围不确定性的影响下剂量线能够覆盖肿瘤[20]。
总结
PBT在早期NSCLC的价值仍未被确认。一般认为,对于小的外周型肺癌,尤其是放疗计划未涉及较多体积的胸壁或肋骨的情况时,PBT并未优于SABR。PBT在某些复杂情况下,可能会有获益:(1)肿瘤体积大(>4cm);(2)中央型肺癌;(3)肺尖肿瘤或靠近臂丛肿瘤;(4)需要治疗多个病变(例如:多原发肿瘤)。仍需要更多的数据评价SBPT对比SABR的安全性和有效性。值得注意的是,唯一的前瞻性研究因为患者入组困难而提前关闭,反映出在该研究领域,设计出有研究内涵、可以临床推广并能充分入组的课题的困难性。当然,先进的IGRT技术在质子治疗领域出现并不断推广,同时广泛开展的还有IMPT技术,这两项技术均会增加SBPT的可能获益,同时,可以克服部分研究入组的障碍。未来的5到10年,将会开展一些适合可行的临床研究来探讨质子放疗的患者筛选问题。
Acknowledgements
None.
Footnote
Conflicts of Interest: The authors have no conflicts of interest to declare.
References
- Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol 2015;16:630-7. [Crossref] [PubMed]
- Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010;303:1070-6. [Crossref] [PubMed]
- Kadoya N, Obata Y, Kato T, et al. Dose-volume comparison of proton radiotherapy and stereotactic body radiotherapy for non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2011;79:1225-31. [Crossref] [PubMed]
- Chang JY, Zhang X, Wang X, et al. Significant reduction of normal tissue dose by proton radiotherapy compared with three-dimensional conformal or intensity-modulated radiation therapy in Stage I or Stage III non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2006;65:1087-96. [Crossref] [PubMed]
- Kesarwala AH, Ko CJ, Ning H, et al. Intensity-modulated proton therapy for elective nodal irradiation and involved-field radiation in the definitive treatment of locally advanced non-small-cell lung cancer: a dosimetric study. Clin Lung Cancer 2015;16:237-44. [Crossref] [PubMed]
- Bush DA, Slater JD, Shin BB, et al. Hypofractionated proton beam radiotherapy for stage I lung cancer. Chest 2004;126:1198-203. [Crossref] [PubMed]
- Bush DA, Slater JD, Bonnet R, et al. Proton-beam radiotherapy for early-stage lung cancer. Chest 1999;116:1313-9. [Crossref] [PubMed]
- Do SY, Bush DA, Slater JD. Comorbidity-adjusted survival in early stage lung cancer patients treated with hypofractionated proton therapy. J Oncol 2010;2010:251208. [Crossref] [PubMed]
- Bush DA, Cheek G, Zaheer S, et al. High-dose hypofractionated proton beam radiation therapy is safe and effective for central and peripheral early-stage non-small cell lung cancer: results of a 12-year experience at Loma Linda University Medical Center. Int J Radiat Oncol Biol Phys 2013;86:964-8. [Crossref] [PubMed]
- Chang JY, Komaki R, Wen HY, et al. Toxicity and patterns of failure of adaptive/ablative proton therapy for early-stage, medically inoperable non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2011;80:1350-7. [Crossref] [PubMed]
- Chang JY, Zhang W, Komaki R, et al. Long-term outcome of phase I/II prospective study of dose-escalated proton therapy for early-stage non-small cell lung cancer. Radiother Oncol 2017;122:274-80. [Crossref] [PubMed]
- Chi A, Chen H, Wen S, et al. Comparison of particle beam therapy and stereotactic body radiotherapy for early stage non-small cell lung cancer: A systematic review and hypothesis-generating meta-analysis. Radiother Oncol 2017;123:346-54. [Crossref] [PubMed]
- Chang JY, Jabbour SK, De Ruysscher D, et al. Consensus Statement on Proton Therapy in Early-Stage and Locally Advanced Non-Small Cell Lung Cancer. Int J Radiat Oncol Biol Phys 2016;95:505-16. [Crossref] [PubMed]
- Register SP, Zhang X, Mohan R, et al. Proton stereotactic body radiation therapy for clinically challenging cases of centrally and superiorly located stage I non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2011;80:1015-22. [Crossref] [PubMed]
- Chang JY, Balter PA, Dong L, et al. Stereotactic body radiation therapy in centrally and superiorly located stage I or isolated recurrent non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2008;72:967-71. [Crossref] [PubMed]
- Shi W, Nichols RC Jr, Flampouri S, et al. Proton-based chemoradiation for synchronous bilateral non-small-cell lung cancers: A case report. Thorac Cancer 2013;4:198-202. [Crossref] [PubMed]
- Nantavithya C, Wei X, Komaki R, et al. Phase 2 Study of Stereotactic Body Radiation Therapy and Stereotactic Body Proton Therapy for High Risk, Medically Inoperable, Early-Stage Non-Small Cell Lung Cancer. Int J Radiat Oncol Biol Phys 2018. In press. [Crossref] [PubMed]
- Moyers MF, Miller DW, Bush DA, et al. Methodologies and tools for proton beam design for lung tumors. Int J Radiat Oncol Biol Phys 2001;49:1429-38. [Crossref] [PubMed]
- Li H, Zhang X, Park P, et al. Robust optimization in intensity-modulated proton therapy to account for anatomy changes in lung cancer patients. Radiother Oncol 2015;114:367-72. [Crossref] [PubMed]
- Chang JY, Li H, Zhu XR, et al. Clinical Implementation of Intensity Modulated Proton Therapy for Thoracic Malignancies. Int J Radiat Oncol Biol Phys 2014;90:809-18. [Crossref] [PubMed]
张涛
国家癌症中心/中国医学科学院北京协和医学院肿瘤医院(更新时间:2021.7)
李凯新
福建医科大学附属泉州第一医院(更新时间:2021.7)
(本译文仅供学术交流,实际内容请以英文原文为准。)


