血液生物标志物与肺癌的预后和治疗决策
前言
肺癌的诊疗、预后和结局可能存在很大的差异。 肿瘤组织的溯源诊断一直是肺癌诊治的金标准;而来自肿瘤组织的生物标志物已成为建立预后和预测指标的重点。 然而,这种诊断方式对肿瘤组织的依赖性存在明显的缺陷,因为它不允许在整个治疗过程中对肿瘤进行连续取样,也不允许进行多次活检以评估肿瘤内异质性。因此,鉴定血液中新的生物标志物以区分肿瘤与正常组织,并预测肿瘤进展,例如病理分期、对化疗或放疗的反应,以及复发情况,在临床实践中非常重要。基于血液的生物标志物可以掌握该疾病的分子多样性,同时有利于对患者进行连续性检测,监测疾病的动态进展。
循环肿瘤细胞(CTC)
有学者认为,CTC是从原发性肿瘤中脱落进入循环系统,与癌症的进展相关[1]。在外周血中鉴定出的肿瘤来源的细胞可用于诊断原始癌症或检测复发,我们称之为液体活检[2]。
迄今为止,已经开发出多种技术来研究CTC分离、鉴定和计数,然而这些方法在CTC的检出率、灵敏度和特异性方面存在很大差异[3]。通常,CTC分析利用带有上皮标志物的方法进行初始富集,以去除血液来源的细胞群,从而对CTC进行识别。然而,由于CTC的稀缺性,缺乏对CTC中生物标志物表达的共识定义以及这些细胞与原发病灶和肿瘤细胞之间存在着异质性,对CTC检测提出了重大挑战。迄今为止,CellSearch(Veridex)系统是目前唯一获得美国FDA批准的用于检测CTC的技术[4-6]。CellSearch (Veridex)采用上皮细胞黏附分子(EpCAM)作为富集方法,通过完整无核细胞对细胞角蛋白阳性着色而白细胞标志物CD45阴性着色的结果确定CTC[7]。
CTC的出现与晚期癌症患者的不良预后相关[8-10]。在一项队列研究中发现采用CellSearch系统对101例NSCLC患者进行检测,CTC数量是总生存期(OS)的一个很好预测因子[11]。以CTC计数超过5个/7.5 mL为基线对患者进行划分,此类NSCLC患者CTC数量与短的无进展生存期(PFS)和OS相关[11]。CTC检测的预后作用也已在手术切除的NSCLC患者中得到证实[10]。此外,一篇Meta分析荟萃了20个临床试验并提取了1 576例NSCLC患者进行研究,也证明了肺癌中CTC的预后意义,该分析显示CTC存在与无病生存期(DFS)的降低和OS减少明显相关[12]。尽管有了这些发现,CTCs仍然没有被常规作为NSCLC预后指标应用于临床。
循环肿瘤基因(ctDNA)
肺癌细胞释放DNA片段入血液,使得这些DNA片段与正常细胞的DNA片段一样,均能在血液无细胞成分中检测到。据推测ctDNA是从死亡/濒死的肿瘤细胞中被动释放进入血流,这是一个与肿瘤负荷、肿瘤生长和抗肿瘤治疗相关的过程。虽然我们早已认识到ctDNA的存在,但直到近期才出现了能够检测到它的灵敏性和特异性的技术。这些技术包括BEAMing小珠(Bead)、乳浊液(Emulsion)、扩增(Amplification)、磁性(Magnetic)技术和CAPP-seq(通过深度测序对癌症进行个性化分析)。
与健康人群相比,NSCLC患者的ctDNA水平一致性增高[13-14]。越来越多的证据证明了ctDNA水平的预后意义。例如,进行一线铂类双药化疗的肺癌患者治疗前ctDNA水平越高,则OS越差(16.8 vs 22.4个月)[15]。在其他报道中,血浆ctDNA水平增高与肿瘤晚期、化疗后肿瘤进展和低生存率相关[16-17]。
最近的一篇报道采用CAPP-Seq ctDNA方法研究了43例肺癌患者采用第三代EGFR抑制剂Rociletinib治疗的耐药机制,在一线抑制剂治疗后在46%患者中发现了多重耐药机制,提示在肿瘤原发病灶内出现了异质性[18]。在另一份报告中,在100%的Ⅱ~Ⅳ期NSCLC患者和50%的Ⅰ期患者中检测到ctDNA,表明其预后价值和特异性为96%[19]。此外,ctDNA水平与肿瘤大小、残余病灶和治疗相关性影像学改变明显相关,这表明与影像学检测相比,ctDNA水平可能更早评估治疗相关反应。
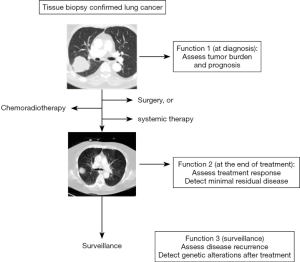
在对肿瘤监测和治疗期间,由于对患者系列标本采集的便利性和从少量ctDNA中就能检测驱动子突变的技术稳定发展,ctDNA检测在肺癌监测和指导治疗中将变得非常有价值。例如,EGFR外显子19缺失的肺癌患者使用厄洛替尼治疗,可能会进展为EGFR基因突变,从而对厄洛替尼治疗耐药。当肿瘤复发或进展时,采血进行EGFR突变分析,有助于临床了解是否肿瘤发生获得性突变,从而对第一代EGFR抑制剂产生了耐药。ctDNA的其他功能包括对微小肿瘤的发生和肿瘤复发可能的监测(图1)[10]。
微小RNA(miRs)
miRs是小的非编码单链RNA,长度为19~22个核苷酸。它们一般是通过沉默mRNA发挥功能,从而在转录后水平上负面调节基因表达[20]。miRs在肿瘤样品中表达的作用已被广泛报道,但是关于循环miRs预后价值的研究却很少。
血清中miR-486、miR-30d、miR-1和miR-499标记已被证明是NSCLC患者独立生存预测因子[21]。在另一份报告中,对193例不同阶段的NSCLC患者的分析显示,miR-125b在血清高表达是存活率低的独立预测因子[22]。Silva等最近鉴定了5个miR基因集作为一个潜在的预后指标,并在78名NSCLC患者和48名对照参与者的单独队列中进行了验证,在同一项研究中,已证明let-7f和miR-30e-3p的水平与不良预后相关[23]。
外泌体是膜封闭的细胞外囊泡(EVs),直径为30~100 nm[24],来源于内体[25]。几乎所有类型的细胞都可以分泌外泌体,并且外泌体的形成和释放受到高度调节。癌细胞会分泌更多的外泌体,可以稳定存在,因此可以从多种体液中分离出来,包括血浆、血清和尿液。而且,当与外泌体一起分离和储存时,包括miRs在内的RNA会更加稳定,从而提供更高的产能。在最近的一项研究[26]中,利用定量聚合酶链反应(qPCR)阵列面板,从10例NSCLC患者和10例健康者的对照中分析了84个血浆外泌体miR样品。外泌体miR-23b-3p,miR-10b-5p和miR-21-5p的升高与短的OS独立相关(风险比为2.42(1.45~4.04),P=0.001;2.22(1.18~4.16),P=0.013;2.12(1.28~3.49),P=0.003)。与从临床预后变量得出的模型进行比较时,添加3个外体miRNA标记显着提高了生存预测准确性,并且ROC曲线下的时间依赖性区域面积从0.88增加到0.91(P=0.015)[26]。
miR不仅可用作诊断和预后的生物标志物,而且还可用作潜在的预后和预测标志物。例如,增加的miR-21导致体外铂耐药,铂类辅助化疗后的DFS相关[27]。血液miR-22水平上调能预测晚期NSCLC患者对培美曲塞的耐药性[28]。
其他血液标志物
目前,对血清或血浆标志物进行了多种尝试开发,以便确定肺癌患者的预后和预测检测标记,包括蛋白组学或基因组学特征。例如,VeriStrat®是采用基质辅助激光解吸/电离(MALDI)质谱进行的血清或血浆检测,是临床特征的独立因素,能预测OS和PFS,检测对厄洛替尼[29]或联合TKI治疗[30]的治疗反应具有很高的预测性。对几项回顾性和前瞻性随机试验样本进行了VeriStrat计算,例如BR21,明确了这个分子标签的相关预后信息。
其他的血清/血浆检测包括血液DNA中的DNA甲基化标签[31]、血清自身抗体抗肿瘤相关性抗原(TAAs)[32]是潜在的早期检测手段和预后指标,但这些检测方法还缺乏特异性,尚需要确定更多稳定的生物标志物以逐渐纳入临床检测应用。
结论
循环肿瘤标志物是一种对预测肺癌患者的结局和疗效非常有用的工具。一些标志物已经纳入临床常规应用。将潜在的生物标志物分析和影像学研究与随机临床试验相结合,将有可能证实基于血液的肿瘤生物标志物在肺癌诊断、预后和研究中的实用性。这一领域的成功很可能鼓舞未来识别和验证新的生物标志物的工作。
Acknowledgements
None.
Footnote
Conflicts of Interest: The authors have no conflicts of interest to declare.
References
- Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000;100:57-70. [Crossref] [PubMed]
- Nagrath S, Sequist LV, Maheswaran S, et al. Isolation of rare circulating tumour cells in cancer patients by microchip technology. Nature 2007;450:1235-9. [Crossref] [PubMed]
- Hanssen A, Loges S, Pantel K, et al. Detection of circulating tumor cells in non-small cell lung cancer. Front Oncol 2015;5:207. [Crossref] [PubMed]
- Xenidis N, Perraki M, Kafousi M, et al. Predictive and prognostic value of peripheral blood cytokeratin-19 mRNA-positive cells detected by real-time polymerase chain reaction in node-negative breast cancer patients. J Clin Oncol 2006;24:3756-62. [Crossref] [PubMed]
- Cohen SJ, Punt CJ, Iannotti N, et al. Relationship of circulating tumor cells to tumor response, progression-free survival, and overall survival in patients with metastatic colorectal cancer. J Clin Oncol 2008;26:3213-21. [Crossref] [PubMed]
- de Bono JS, Scher HI, Montgomery RB, et al. Circulating tumor cells predict survival benefit from treatment in metastatic castration-resistant prostate cancer. Clin Cancer Res 2008;14:6302-9. [Crossref] [PubMed]
- Allard WJ, Matera J, Miller MC, et al. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin Cancer Res 2004;10:6897-904. [Crossref] [PubMed]
- Mocellin S, Hoon D, Ambrosi A, et al. The prognostic value of circulating tumor cells in patients with melanoma: a systematic review and meta-analysis. Clin Cancer Res 2006;12:4605-13. [Crossref] [PubMed]
- Rolfo C, Castiglia M, Hong D, et al. Liquid biopsies in lung cancer: the new ambrosia of researchers. Biochim Biophys Acta 2014;1846:539-46. [PubMed]
- Pérez-Callejo D, Romero A, Provencio M, et al. Liquid biopsy based biomarkers in non-small cell lung cancer for diagnosis and treatment monitoring. Transl Lung Cancer Res 2016;5:455-65. [Crossref] [PubMed]
- Krebs MG, Sloane R, Priest L, et al. Evaluation and prognostic significance of circulating tumor cells in patients with non-small-cell lung cancer. J Clin Oncol 2011;29:1556-63. [Crossref] [PubMed]
- Wang J, Wang K, Xu J, et al. Prognostic significance of circulating tumor cells in non-small-cell lung cancer patients: a meta-analysis. PLoS One 2013;8:e78070. [Crossref] [PubMed]
- Sozzi G, Conte D, Leon M, et al. Quantification of free circulating DNA as a diagnostic marker in lung cancer. J Clin Oncol 2003;21:3902-8. [Crossref] [PubMed]
- Paci M, Maramotti S, Bellesia E, et al. Circulating plasma DNA as diagnostic biomarker in non-small cell lung cancer. Lung Cancer 2009;64:92-7. [Crossref] [PubMed]
- Catarino R, Coelho A, Araújo A, et al. Circulating DNA: diagnostic tool and predictive marker for overall survival of NSCLC patients. PLoS One 2012;7:e38559. [Crossref] [PubMed]
- Gautschi O, Bigosch C, Huegli B, et al. Circulating deoxyribonucleic Acid as prognostic marker in non-small-cell lung cancer patients undergoing chemotherapy. J Clin Oncol 2004;22:4157-64. [Crossref] [PubMed]
- Nygaard AD, Holdgaard PC, Spindler KL, et al. The correlation between cell-free DNA and tumour burden was estimated by PET/CT in patients with advanced NSCLC. Br J Cancer 2014;110:363-8. [Crossref] [PubMed]
- Chabon JJ, Simmons AD, Lovejoy AF, et al. Circulating tumour DNA profiling reveals heterogeneity of EGFR inhibitor resistance mechanisms in lung cancer patients. Nat Commun 2016;7:11815. [Crossref] [PubMed]
- Newman AM, Bratman SV, To J, et al. An ultrasensitive method for quantitating circulating tumor DNA with broad patient coverage. Nat Med 2014;20:548-54. [Crossref] [PubMed]
- Ha M, Kim VN. Regulation of microRNA biogenesis. Nat Rev Mol Cell Biol 2014;15:509-24. [Crossref] [PubMed]
- Hu Z, Chen X, Zhao Y, et al. Serum microRNA signatures identified in a genome-wide serum microRNA expression profiling predict survival of non-small-cell lung cancer. J Clin Oncol 2010;28:1721-6. [Crossref] [PubMed]
- Yuxia M, Zhennan T, Wei Z. Circulating miR-125b is a novel biomarker for screening non-small-cell lung cancer and predicts poor prognosis. J Cancer Res Clin Oncol 2012;138:2045-50. [Crossref] [PubMed]
- Silva J, García V, Zaballos Á, et al. Vesicle-related microRNAs in plasma of nonsmall cell lung cancer patients and correlation with survival. Eur Respir J 2011;37:617-23. [Crossref] [PubMed]
- Théry C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function. Nat Rev Immunol 2002;2:569-79. [PubMed]
- Raposo G, Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends. J Cell Biol 2013;200:373-83. [Crossref] [PubMed]
- Liu Q, Yu Z, Yuan S, et al. Circulating exosomal microRNAs as prognostic biomarkers for non-small-cell lung cancer. Oncotarget 2017;8:13048-58. [PubMed]
- Gao W, Lu X, Liu L, et al. MiRNA-21: a biomarker predictive for platinum-based adjuvant chemotherapy response in patients with non-small cell lung cancer. Cancer Biol Ther 2012;13:330-40. [Crossref] [PubMed]
- Franchina T, Amodeo V, Bronte G, et al. Circulating miR-22, miR-24 and miR-34a as novel predictive biomarkers to pemetrexed-based chemotherapy in advanced non-small cell lung cancer. J Cell Physiol 2014;229:97-9. [PubMed]
- Carbone DP, Ding K, Roder H, et al. Prognostic and predictive role of the VeriStrat plasma test in patients with advanced non-small-cell lung cancer treated with erlotinib or placebo in the NCIC Clinical Trials Group BR.21 trial. J Thorac Oncol 2012;7:1653-60. [Crossref] [PubMed]
- Kuiper JL, Lind JS, Groen HJ, et al. VeriStrat(®) has prognostic value in advanced stage NSCLC patients treated with erlotinib and sorafenib. Br J Cancer 2012;107:1820-5. [Crossref] [PubMed]
- Lissa D, Robles AI. Methylation analyses in liquid biopsy. Transl Lung Cancer Res 2016;5:492-504. [Crossref] [PubMed]
- Dai L, Tsay JC, Li J, et al. Autoantibodies against tumor-associated antigens in the early detection of lung cancer. Lung Cancer 2016;99:172-9. [Crossref] [PubMed]
廖林虹
江西省赣州市妇幼保健院(更新时间:2021.7)
伍鸿荣
中南大学(更新时间:2021.7)
李伟松
赣南医学院第一附属医院(更新时间:2021.7)
(本译文仅供学术交流,实际内容请以英文原文为准。)