
免疫治疗是晚期非小细胞肺癌去化疗的关键,或还是未到时候?
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)改变了缺乏驱动基因突变的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗前景。2016年,Reck及其同事首次报道了与传统化疗相比,帕博利珠单抗(pembrolizumab)针对PD-L1肿瘤比例评分(tumour proportion score,TPS)≥50%的晚期NSCLC患者更胜一筹(KEYNOTE 024研究)[1]。该研究纳入了高TPS≥50%,ECOG表现状态评分0~1的晚期NSCLC患者,而具有敏感EGFR突变、ALK重排或未经治疗的脑转移患者则被排除。无进展生存期(progression free survival, PFS)是主要研究终点,总生存期(overall survival,OS)、客观反应率(objective response rates,ORR)和安全性是关键的次要终点。该研究允许在出现疾病进展时从化疗组交叉到帕博利珠单抗组。根据数据和安全监测委员会的建议,该研究在第二次中期分析中显示出帕博利珠单抗组具有在OS上的优势后便提前终止了。与化疗组相比,帕博利珠单抗组的PFS(10.3个月vs. 6个月,P<0.001)和OS(预计6个月OS 80.2% vs. 72.4%,P=0.005)均有改善。尽管从化疗组到帕博利珠单抗组的初始交叉率高达43%。此外,与化疗组相比,帕博利珠单抗组与较高的ORR(44.8% vs. 27.8%)和较少的3~5级治疗相关毒性事件发生率(27% vs. 53%)相关。入组到帕博利珠单抗组的患者也得到了生活质量的改善,延迟了症状恶化[2]。
在这次数据更新中,作者报告了更新后的OS和耐受性分析。他们采用了3种统计学方法,以校正化疗组交叉至帕博利珠单抗组而带来的潜在偏倚。中位随访25.2个月后,与化疗组相比,帕博利珠单抗组的生存率增加了一倍(30个月vs. 14.9个月,标称P=0.002)。在数据截止时,54.3%的患者从化疗组中交叉至帕博利珠单抗组治疗。另外15名患者在交叉治疗之外接受抗PD-1治疗,在意向性(intention to treat,ITT)人群中交叉率为64.2%[3]。
其中一些调查结果值得注意,尽管交叉率很高,但校正交叉治疗潜在偏差的分析显示,帕博利珠单抗组的风险比(hazard ratios,HR)始终更由于化疗组。随着随访时间延长,生存曲线出现明显分离,说明OS的获益得以维持。在那些化疗后接受二线帕博利珠单抗治疗的患者中,ORR为20.9%:该结果与之前的二线抗PD-1治疗研究是相似的[4-6]。安全性分析也倾向于帕博利珠单抗组,而且随访时间越长,3~5级治疗相关不良事件越低(31%vs. 53%)。
而当前更新数据的不足之处包括中位随访期为25.2个月,相对较短。相比之下,在已更新的CA209-003研究——一项纳武利尤单抗一线治疗NSCLC的研究中报道的最低随访期达58.5个月之久[7]。在KEYNOTE 024研究中,帕博利珠单抗的治疗可持续2年,在更新分析时,11.0%的患者已完成治疗,而19.9%的患者仍在治疗中。该研究按方案治疗(per protocol treatment,PPT)结束后,更长的随访结果将会公布并且提供强大的长期安全性和疗效数据。
校正交叉治疗影响的三个统计模型仍然存在内在的错误因素,公认的标准仍是ITT分析。保秩结构失效时间校正模型(rank-preserving structural failure time,RPSFT)假设了帕博利珠单抗无论一线治疗或交叉治疗的常见治疗效果。而逆概率删失加权分析(inverse probability of censoring weighting,IPCW)和简化的两阶段方法可能由于高交叉率而增加了错误风险,并且两者都假设没有未测量的混杂因素。尽管存在这些技术限制,但这三种方法在帕博利珠单抗组的OS中都得到了相似的校正HR(两阶段,TPSFT,IPCW分别为0.49,0.52,0.52),表明结果可靠。鉴于ITT人群的显著结果,这种校正分析不会改变研究或治疗影响的总体结果,但强调了帕博利珠单抗单药治疗对该人群的显著获益。
目前已经进行的一些单药ICI一线治疗的临床试验见于(表1)。
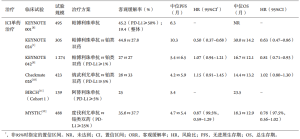
Full table
在CHECKMATE 026研究,纳武利尤单抗的Ⅲ期研究中,没有观察到OS的益处(HR 1.02)。KEYNOTE 024研究和CHECKMATE 026研究结果之间的差异可能归因于患者人群和PD-L1检测的差异[13]。最近,KEYNOTE 042研究报道了一线帕博利珠单抗与铂类化疗相比,在初治的NSCLC患者中,PD-L1 TPS≥1%这部分人群具有OS上的获益[9]。在中位随访12.8个月时,所有亚组的OS均获益:TPS≥50%(20个月 vs. 12.2个月,P=0.0003);TPS≥20%(17.7个月vs. 13.0个月,P=0.002);TPS≥1%(16.7个月 vs. 12.1个月,P=0.0018)。值得注意的是,PD-L1 TPS ≥50%的患者约占整个队列的一半——这一比例远远高于一般人群中的30%[11]。由于高TPS组在很大程度上推动了OS获益,因此该研究强调了帕博利珠单抗单药治疗在TPS高达50%的患者中的优势。然而,与KEYNOTE 024研究不同,在KEYNOTE 042研究中具有PD-L1 TPS≥50%的高表达患者接受帕博利珠单抗治疗,与化疗相比在PFS中没有显示出优势。根据KEYNOTE 042研究的结果,美国FDA最近批准帕博利珠单抗用于PD-L1表达至少为1%的晚期NSCLC患者。
除单药ICI外,其他研究还评估了ICI联合化疗或联合另一种ICI,见于(表2)。
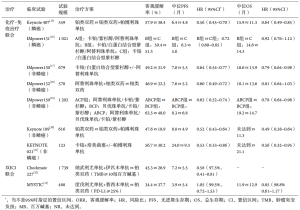
Full table
在KEYNOTE 189研究——一项评估帕博利珠单抗联合培美曲塞及铂类对比安慰剂联合化疗治疗转移性非鳞NSCLC的III期临床研究中,帕博利珠单抗联合化疗组的OS(12个月OS 69.2% vs. 49.4%,P<0.001)和PFS(8.8 vs. 4.9个月,P<0.001)获得显著改善,而不论PD-L1的表达水平。帕博利珠单抗联合化疗组和对照组的ORR分别为47.6%和18.9%。在TPS≥50%的患者亚组中,帕博利珠单抗联合化疗组的ORR高达61%[19]。在晚期鳞状NSCLC患者的研究中(KEYNOTE 407研究),与安慰剂联合化疗相比,帕博利珠单抗联合卡铂和紫杉醇或白蛋白结合型紫杉醇则获得OS(15.9个月 vs. 11.3个月,P<0.001)和PFS(6.4个月 vs. 4.8个月, P<0.001)的显著改善[13],所有PD-L1表达水平的亚组类别都有获益。无论PD-L1表达如何,KEYNOTE 189研究和KEYNOTE 407研究都分别确定了非鳞状和鳞状NSCLC中一线帕博利珠单抗和化疗联合治疗的作用。
阿特利珠单抗是一种抗PD-L1抗体,其联合化疗的相关研究也已在晚期非鳞状和鳞状NSCLC人群中进行。在IMPOWER 130研究中,与单独化疗方案相比,在卡铂和白蛋白结合型紫杉醇联合阿特利珠单抗的方案获得PFS(7.0个月 vs. 5.5个月;P<0.0001)和OS(18.6个月 vs. 13.9个月;P=0.033)的显著改善,而且所有PD-L1亚组均可获益[16]。一项使用铂类和培美曲塞联合阿特利珠单抗方案治疗非鳞状NSCLC的研究也显示,加用阿特利珠单抗后,PFS得到改善(7.6个月 vs. 5.2个月,P<0.0001)[17]。然而在中期分析中,OS并没有差异。在IMPOWER 150研究:一项三臂Ⅲ期研究评估:①阿特利珠单抗联合卡铂和紫杉醇;②阿特利珠单抗联合贝伐珠单抗、卡铂和紫杉醇,或③贝伐珠单抗联合卡铂和紫杉醇,共三种方案治疗初治非鳞状晚期NSCLC[18],该研究纳入了一小部分EGFR突变和ALK重排的患者。在野生型(WT)人群中,与贝伐珠单抗和化疗方案相比,在贝伐珠单抗和化疗的基础上加入阿特利珠单抗治疗后,PFS(8.3个月 vs. 6.8个月,P<0.001)和OS(19.2个月 vs. 14.7个月,P=0.02)均有所改善。在ITT人群中也观察到PFS的改善,PFS为8.3个月 vs. 6.8个月(P<0.0001),其中也包括EGFR突变和ALK重排的患者。这项研究揭示了化疗-免疫治疗组合对于驱动基因突变NSCLC患者在靶向治疗出现进展后的可能益处。然而,我们需要进行前瞻性大型随机对照试验来验证这一观点。在IMPOWER 131研究(针对晚期鳞状NSCLC)中,与化疗相比,阿特利珠单抗联合卡铂和白蛋白结合型紫杉醇方案的PFS有所改善(6.3个月 vs. 5.6个月;P=0.0001),但在中期分析中OS并无差异。
双ICI联合方案用于一线治疗的研究也有报道。CHECKMATE 227研究将晚期NSCLC患者随机分组为铂类双药化疗,纳武利尤单抗联合伊匹木单抗,或纳武利尤单抗单药治疗(对PD-L1表达水平≥1%的人群),或者纳武利尤单抗联合化疗(对PD-L1表达水平<1%的人群)[21]。在高肿瘤突变负荷(tumour mutational burden, TMB)的患者中,无论PD-L1表达状态如何,使用纳武利尤单抗联合伊匹木单抗可以得到PFS的获益(7.2个月 vs. 5.5个月;P<0.001)。对于高TMB的患者,双免疫联合治疗的ORR也较高(45.3% vs. 26.9%)。值得注意的是,在1年时,使用纳武利尤单抗联合伊匹木单抗治疗的患者与铂类双药化疗患者相比表现出持续的应答(68% vs. 25%)。尽管如此,仍需要来自更长时间的随访和OS数据。来自纳武利尤单抗联合化疗对比铂类双药化疗的CHECKMATE 227研究的初步结果显示,PD-L1<1%的患者的PFS有所改善。
尽管来自KEYNOTE 024研究更新的数据较为积极,临床实践中仍存在一些问题。当不需要考虑PD-L1表达情况,随着帕博利珠单抗和化疗联合方案作为NSCLC一线治疗的建立[14,19],对于高TPS≥50%的患者,我们是否应该选择帕博利珠单抗单药还是免疫治疗联合化疗呢?是否还有一部分患者可以从帕博利珠单抗单药治疗中获益呢?鉴于现有数据,我们认为应该在相对无症状的患者中考虑使用帕博利珠单抗单药。对于有症状或者疾病出现进展的患者,应考虑联合治疗方法:比如帕博利珠单抗联合化疗,或使用阿特珠单抗联合贝伐珠单抗、卡铂和紫杉醇的四药联合方案,所有这些方案用于一线治疗的适应症均已获得美国食品药品管理局(Food and Drug Administration,FDA)批准。但是其它的联合方案如阿特珠单抗联合铂类和紫杉醇或培美曲塞尚未获得批准[15-17]。
在PD-L1 TPS<1%~49%的这部分患者中,与化疗相比,帕博利珠单抗能否改善OS仍然是一个尚未明确的临床问题。在KEYNOTE 042研究对PD-L1 TPS 1%~49%患者的探索性分析中,帕博利珠单抗组与化疗组之间的OS并无差异[9]。评估在PD-L1低表达(<50%)的晚期NSCLC中帕博利珠单抗一线治疗疗效的Ⅱ期PEOPLE试验目前正在进行中(ClinicalTrial.gov注册号NCT03447678)。
一些试验正在研究ICIs联合治疗以及ICI与新一代免疫疗法联合治疗方案。此类药物包括肿瘤疫苗疗法(TG4010),LAG3融合蛋白和肿瘤浸润淋巴细胞(TIL)(ClinicalTrial.gov注册号NCT03353675,NCT03625323,NCT03215810)。靶病灶放射治疗作为免疫诱导与ICI联合治疗的作用也在研究中(ClinicalTrials.gov注册号NCT03168464)。随着ICI在NSCLC治疗中的作用愈来重要,患者的筛选是关键。目前,PD-L1仍然是唯一确认的广泛应用于临床的生物标志物。由于高TMB可从ICI联合治疗中获益,TMB似乎是一种有前景的生物标志物,但尚未广泛应用[22]。而且无限期使用ICI相关的显著临床毒性和经济负担使得我们还需要进一步考虑治疗的持续时间问题。CHECKMATE 153研究显示,与治疗1年后停药相比,持续纳武利尤单抗治疗直至出现进展可获得PFS的改善,但目前还需要等待长期OS数据支持[23]。正在招募中的DICIPLE试验研究设计将ICI联合治疗6个月,至出现进展时再次治疗与持续ICI联合治疗直至出现进展进行比较(ClinicalTrials.gov注册号NCT03469960)。
总之,KEYNOTE 024研究已奠定了帕博利珠单抗单药治疗在高PD-L1 TPS≥50%的晚期NSCLC中的作用,而且在更长的随访中具有持续的OS获益和可接受的药物毒性的优势。目前帕博利珠单抗和化疗的联合治疗方案也已获得批准,我们在所有PD-L1表达水平上均可看到益处。目前,我们期待着其他化疗-免疫治疗联合方案和双免疫治疗联合方案的更多数据和更长时间的随访结果。
Acknowledgments
None.
Footnote
Conflicts of Interest: RA Soo has received honorarium from Astra-Zeneca, BMS, Boehringer Ingelheim, Celgene, Lilly, Merck, Novartis, Pfizer, Roche, Taiho, Takeda, and Yuhan and research funding from Astra-Zeneca and Boehringer Ingelheim. The other authors have no conflicts of interest to declare.
References
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer. N Engl J Med 2016;375:1823-33. [Crossref] [PubMed]
- Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol 2017;18:1600-9. [Crossref] [PubMed]
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non–Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50% or Greater. J Clin Oncol 2019;37:537-46. [Crossref] [PubMed]
- Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016;387:1540-50. [Crossref] [PubMed]
- Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non–Small-Cell Lung Cancer. N Engl J Med 2015;373:123-35. [Crossref] [PubMed]
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non–Small-Cell Lung Cancer. N Engl J Med 2015;373:1627-39. [Crossref] [PubMed]
- Gettinger S, Horn L, Jackman D, et al. Five-Year Follow-Up of Nivolumab in Previously Treated Advanced Non–Small-Cell Lung Cancer: Results From the CA209-003 Study. J Clin Oncol 2018;36:1675-84. [Crossref] [PubMed]
- Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the Treatment of Non–Small-Cell Lung Cancer. N Engl J Med 2015;372:2018-28. [Crossref] [PubMed]
- Mok TS, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet 2019. [Epub ahead of print]. [Crossref] [PubMed]
- Carbone DP, Reck M, Paz-Ares L, et al. First-Line Nivolumab in Stage IV or Recurrent Non–Small-Cell Lung Cancer. N Engl J Med 2017;376:2415-26. [Crossref] [PubMed]
- Peters S, Gettinger S, Johnson ML, et al. Phase II Trial of Atezolizumab As First-Line or Subsequent Therapy for Patients With Programmed Death-Ligand 1–Selected Advanced Non–Small-Cell Lung Cancer (BIRCH). J Clin Oncol 2017;35:2781-9. [Crossref] [PubMed]
- Rizvi NA, Chul Cho B, Reinmuth N, et al. LBA6Durvalumab with or without tremelimumab vs platinum-based chemotherapy as first-line treatment for metastatic non-small cell lung cancer: MYSTIC. Ann Oncol 2018. [Crossref]
- Huang Y, Soo RA. The KEY to the end of chemotherapy in non-small cell lung cancer? Ann Transl Med 2017;5:166. [Crossref] [PubMed]
- Smit EF, de Langen AJ. Pembrolizumab for all PD-L1-positive NSCLC. Lancet 2019;393:1776-8. [Crossref] [PubMed]
- Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus Chemotherapy for Squamous Non–Small-Cell Lung Cancer. N Engl J Med 2018;379:2040-51. [Crossref] [PubMed]
- Jotte RM, Cappuzzo F, Vynnychenko I, et al. IMpower131: Primary PFS and safety analysis of a randomized phase III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs carboplatin + nab-paclitaxel as 1L therapy in advanced squamous NSCLC. J Clin Oncol 2018;36:LBA9000. [Crossref]
- Cappuzzo F, Mekhail T, Zer A, et al. LBA53IMpower130: Progression-free survival (PFS) and safety analysis from a randomised phase III study of carboplatin + nab-paclitaxel (CnP) with or without atezolizumab (atezo) as first-line (1L) therapy in advanced non-squamous NSCLC. Ann Oncol 2018.29.
- Papadimitrakopoulou V, Cobo M, Bordoni R, et al. OA05.07 IMpower132: PFS and Safety Results with 1L Atezolizumab + Carboplatin/Cisplatin + Pemetrexed in Stage IV Non-Squamous NSCLC. J Thorac Oncol 2018;13:S332-3. [Crossref]
- Socinski MA, Jotte RM, Cappuzzo F, et al. Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC. N Engl J Med 2018;378:2288-301. [Crossref] [PubMed]
- Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer. N Engl J Med 2018;378:2078-92. [Crossref] [PubMed]
- Borghaei H, Langer CJ, Gadgeel S, et al. 24-Month Overall Survival from KEYNOTE-021 Cohort G: Pemetrexed and Carboplatin with or without Pembrolizumab as First-Line Therapy for Advanced Nonsquamous Non-Small Cell Lung Cancer. J Thorac Oncol 2019;14:124-9. [Crossref] [PubMed]
- Hellmann MD, Ciuleanu TE, Pluzanski A, et al. Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden. N Engl J Med 2018;378:2093-104. [Crossref] [PubMed]
- Socinski MA, Koynov KD, Berard H, et al. LBA65IMpower131: Progression-free survival (PFS) and overall survival (OS) analysis of a randomised phase III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs carboplatin + nab-paclitaxel in 1L advanced squamous NSCLC. Ann Oncol 2018.29.
- Borghaei H, Hellmann MD, Paz-Ares LG, et al. Nivolumab (Nivo) + platinum-doublet chemotherapy (Chemo) vs chemo as first-line (1L) treatment (Tx) for advanced non-small cell lung cancer (NSCLC) with <1% tumor PD-L1 expression: Results from CheckMate 227. J Clin Oncol 2018;36:9001. [Crossref]
- Spigel D. 1297O - Randomized results of fixed-duration (1-yr) vs continuous nivolumab in patients (pts) with advanced non-small cell lung cancer (NSCLC). Available online: https://www.primeoncology.org/app/uploads/prime_activities/42584/VPS_Madrid_1297O_Lung_Spigel.pdf
许可
广州医科大学附属第一医院胸外科(更新时间:2021.7)
郭天兴
福建医科大学省立临床医学院(更新时间:2021.7)
(本译文仅供学术交流,实际内容请以英文原文为准。)


